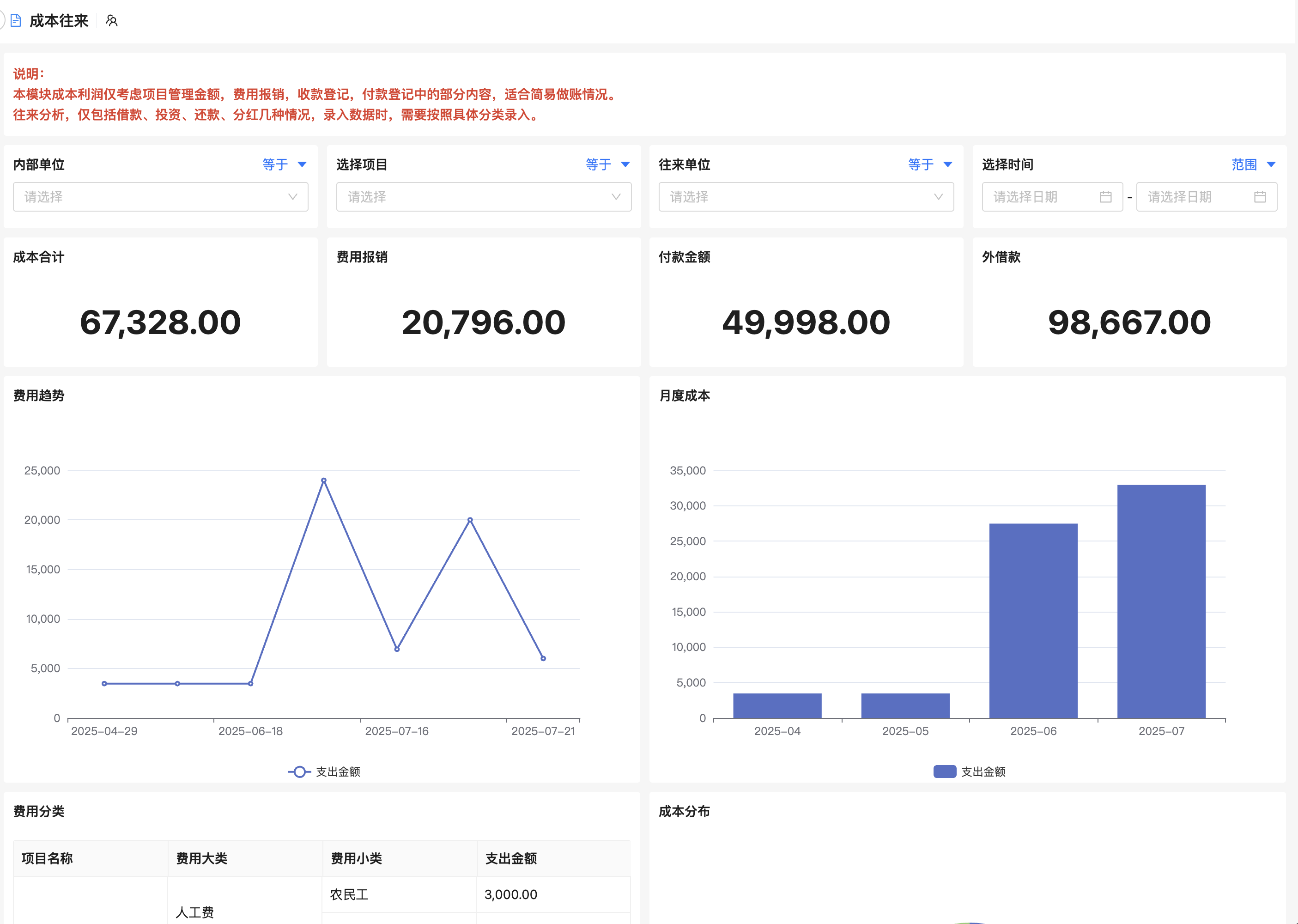
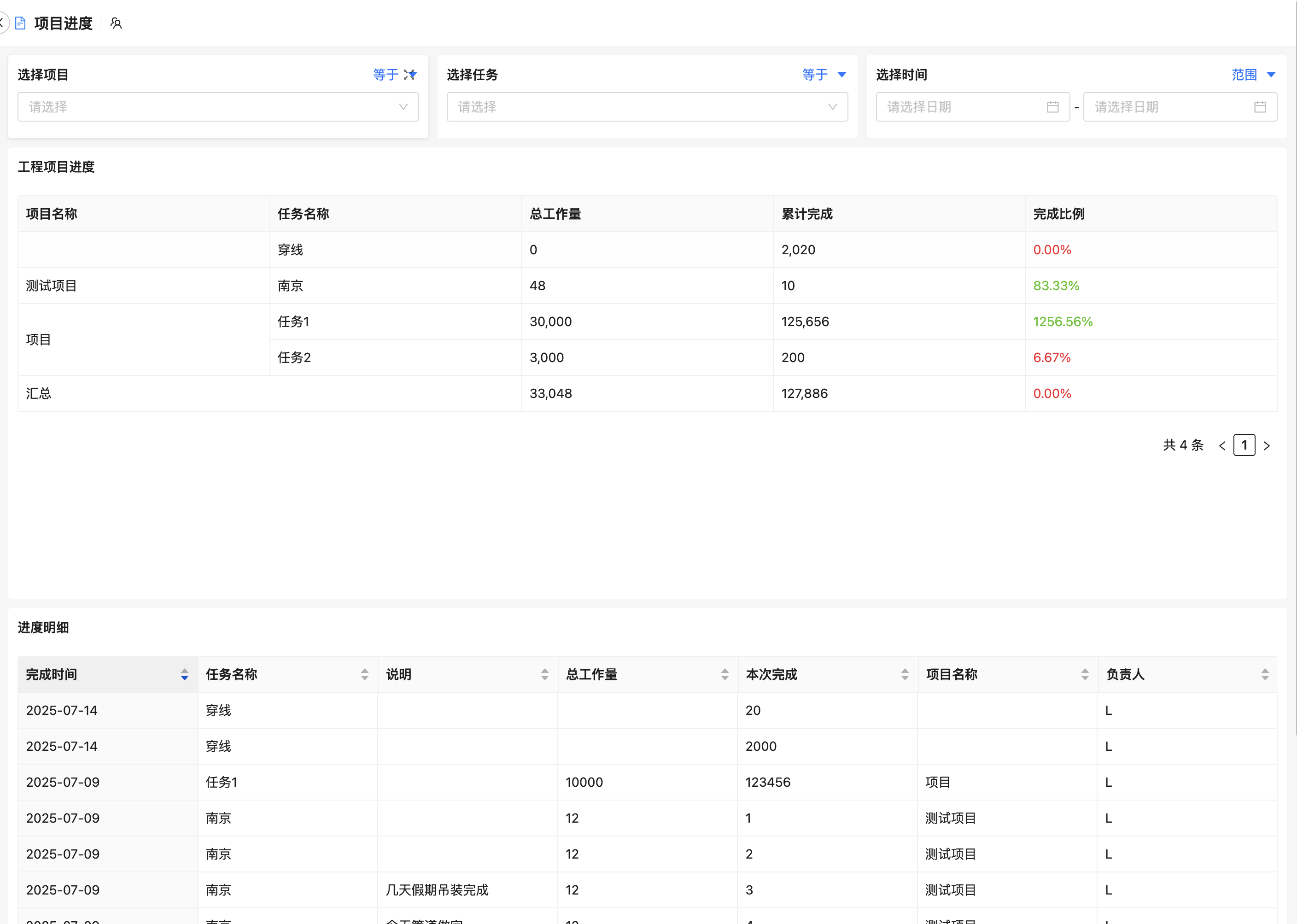
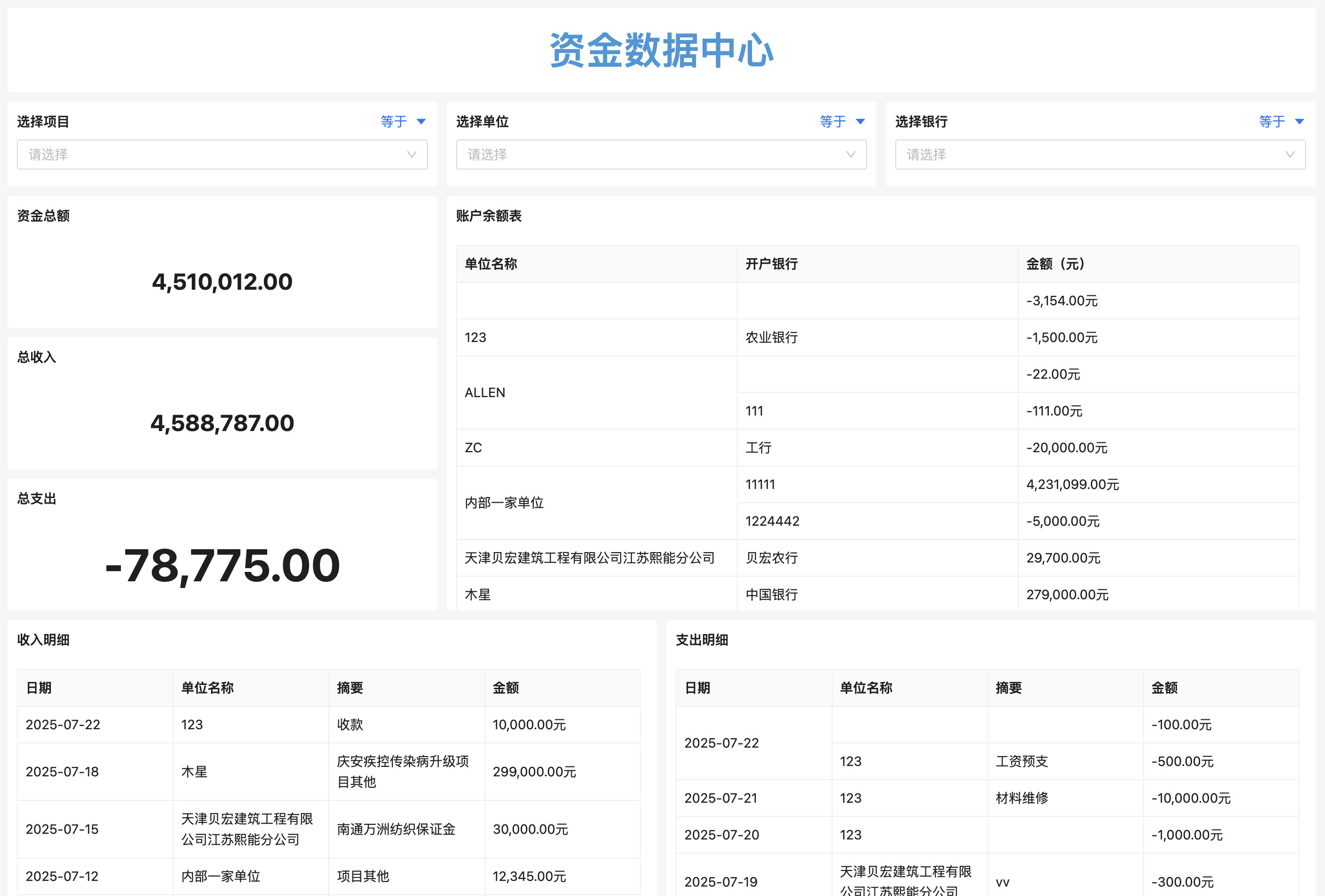
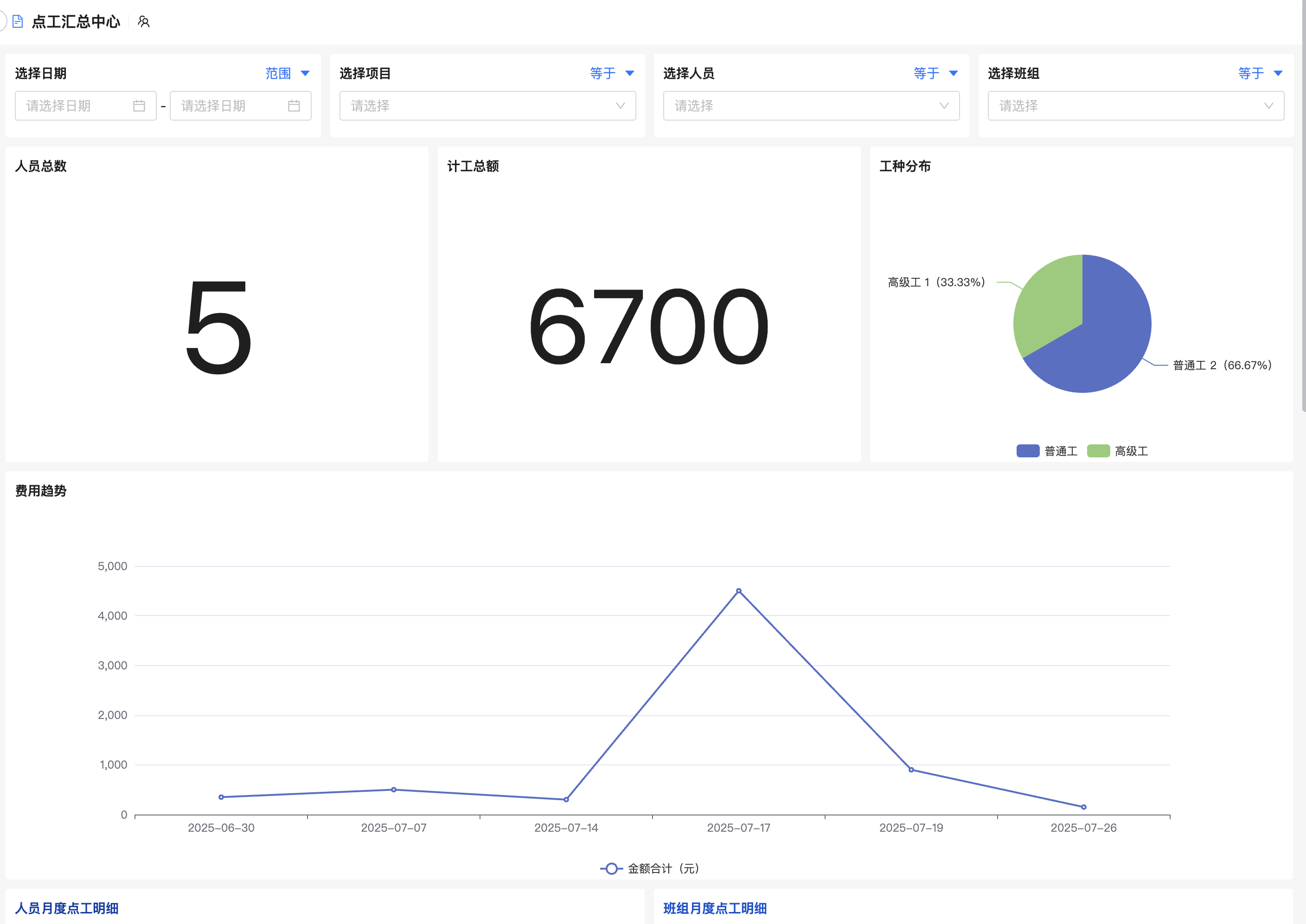
医疗器械工程变更管理怎么做才能确保合规与高效?
在医疗器械行业中,产品设计、生产工艺、原材料或质量管理体系的任何微小变动都可能对产品的安全性、有效性产生深远影响。因此,科学、系统且符合法规要求的工程变更管理(Engineering Change Management, ECM)是企业持续合规运营的核心环节。本文将深入探讨医疗器械工程变更管理的关键流程、常见挑战、最佳实践以及如何借助数字化工具实现高效管控,帮助企业从源头规避风险、提升效率。
一、什么是医疗器械工程变更管理?
医疗器械工程变更管理是指企业在产品生命周期中,对涉及设计、工艺、材料、设备、供应商或生产环境等要素的变更进行识别、评估、批准、实施、验证和记录的一套结构化流程。其目标是在不影响产品安全性和有效性的前提下,优化资源配置、降低成本并加速上市进程。
根据《医疗器械监督管理条例》及ISO 13485:2016质量管理体系标准,企业必须建立并维护有效的变更控制程序,确保所有变更活动受控、可追溯,并符合监管机构(如NMPA、FDA、EMA)的要求。
二、为什么要重视医疗器械工程变更管理?
1. 法规合规性要求严格
全球范围内,医疗器械监管趋严。例如,中国国家药监局(NMPA)发布的《医疗器械生产质量管理规范》明确指出:企业应建立变更控制程序,涵盖研发、生产、检验、包装、储存全过程的变更管理。若未按程序执行,可能导致产品召回、处罚甚至停产。
2. 风险防控关键环节
一次未经充分评估的变更,可能导致临床不良事件、性能下降或不符合预期用途。如某一次性注射器因材料供应商更换未做生物相容性重新测试,导致患者过敏反应频发,最终被FDA发出警告信。
3. 提升研发与制造协同效率
高效的变更管理系统能够打通研发、工程、质量、供应链等部门的信息壁垒,减少重复沟通成本,加快新产品导入(NPI)速度,同时降低返工率和库存浪费。
三、医疗器械工程变更管理的核心流程
1. 变更识别与申请
变更可由内部部门(如研发、生产、质量、采购)提出,也可来自外部(客户投诉、法规更新、供应商变更)。申请人需填写《工程变更申请单》,详细描述变更内容、原因、影响范围及初步建议。
2. 影响评估与风险分析
由跨职能团队(QA、QE、PE、SQE、注册、临床等)共同评审变更的影响,使用FMEA(失效模式与影响分析)、风险矩阵等工具量化风险等级。重点关注:
- 是否影响产品安全性和有效性
- 是否需要重新进行临床评价或生物相容性测试
- 是否涉及注册信息变更(如标签、说明书、技术文档)
- 是否影响现有工艺稳定性或洁净度控制
3. 审批与决策
依据风险级别设定审批权限:低风险变更由项目经理审批;中高风险需质量负责人或高层管理人员签字确认。必要时召开变更控制委员会(CCB)会议集体决策。
4. 实施与验证
制定详细的实施计划,包括时间节点、责任人、资源调配。变更完成后必须进行验证,如小批量试产、性能测试、稳定性研究、过程能力分析(Cpk)等,确保变更达到预期效果。
5. 文件更新与归档
所有相关文件(SOP、BOM、工艺卡、检验规程、注册资料)同步更新,并通过电子文档管理系统(EDMS)版本控制,防止误用旧版文件。变更记录至少保存至产品退市后五年以上。
四、常见问题与挑战
1. 缺乏标准化流程
部分中小企业仍采用手工台账或Excel管理变更,易造成遗漏、滞后或责任不清,难以满足审计需求。
2. 跨部门协作不畅
研发与生产之间存在“信息孤岛”,导致变更落地困难。例如,研发更改了电路板布局但未通知生产,导致装配错误。
3. 忽视变更后的持续监控
许多企业只关注变更执行阶段,忽视变更生效后的数据跟踪(如不良事件报告、客户反馈),无法及时发现潜在隐患。
4. 数字化程度低
传统纸质流程效率低下,审批周期长,不利于快速响应市场变化。据调研,平均每个变更处理时间超过2周,严重影响项目进度。
五、最佳实践建议
1. 建立基于风险的分级管理制度
将变更分为A类(重大变更,如设计变更、关键工艺参数调整)、B类(中等变更,如非关键材料替换)、C类(轻微变更,如包装标签修改),分别设定不同的评审强度和审批层级。
2. 引入变更管理系统(ECM系统)
部署专业的医疗器械变更管理软件(如蓝燕云、MasterControl、Veeva Vault QMS),实现全流程在线流转、自动提醒、权限控制和电子签名,提高透明度与合规性。
3. 加强员工培训与意识培养
定期组织变更管理专题培训,使全员理解变更的重要性,避免“临时应付”心态。特别是新员工入职时应纳入质量管理培训必修课。
4. 建立闭环机制与KPI考核
设置变更完成率、平均处理时长、再发生率等指标,纳入绩效考核体系,推动持续改进。例如,某企业通过设立“变更及时关闭奖”,将平均处理时间从18天缩短至7天。
5. 与注册申报联动管理
对于涉及注册信息的变更(如结构、功能、适应症),应在变更前咨询注册部门,提前准备补充资料,避免后期补录延误上市节奏。
六、未来趋势:智能化与数字化驱动变革
随着AI、大数据和物联网技术的发展,医疗器械工程变更管理正迈向智能化。例如:
- 利用AI算法自动识别变更风险点,辅助决策
- 通过MES系统实时采集生产数据,自动触发变更验证
- 区块链技术保障变更记录不可篡改,增强审计可信度
这些创新手段将进一步提升变更管理的精准性和响应速度,助力企业构建敏捷型质量管理体系。
结语:打造高效、合规的医疗器械变更管理闭环
医疗器械工程变更管理不仅是合规底线,更是企业竞争力的重要体现。只有建立清晰的流程、强大的跨部门协作机制、先进的数字化工具支持,才能真正实现“变而不乱、控而有序”。对于正在寻求质量升级的企业而言,现在正是优化变更管理体系的最佳时机。
推荐您尝试蓝燕云:https://www.lanyancloud.com,这是一款专为医疗器械行业打造的变更管理平台,支持全生命周期变更追踪、风险评估模板、多角色协同审批等功能,目前提供免费试用,欢迎体验!