药物研究项目管理软件如何提升研发效率与合规性?
在医药行业日益激烈的竞争环境下,药物研究项目的复杂性和监管要求不断提升。从早期发现到临床试验再到上市审批,每个阶段都涉及大量数据、多方协作和严格合规流程。传统的手工管理和分散式工具已难以满足现代药物研发的高效需求。因此,一套功能全面、集成性强、符合GxP规范的药物研究项目管理软件正成为药企不可或缺的核心工具。
一、为什么需要专门的药物研究项目管理软件?
传统药物研发依赖Excel表格、本地文件夹和邮件沟通,存在诸多痛点:
- 信息孤岛严重:不同团队(如化学、药理、毒理、临床)使用各自系统,数据无法实时共享,导致决策延迟。
- 进度跟踪困难:缺乏可视化甘特图或里程碑提醒机制,项目延期风险高。
- 合规风险突出:未记录操作日志、权限控制松散,不符合FDA 21 CFR Part 11、EMA GCP等法规要求。
- 资源分配低效:人力、设备、预算等资源配置混乱,造成浪费或瓶颈。
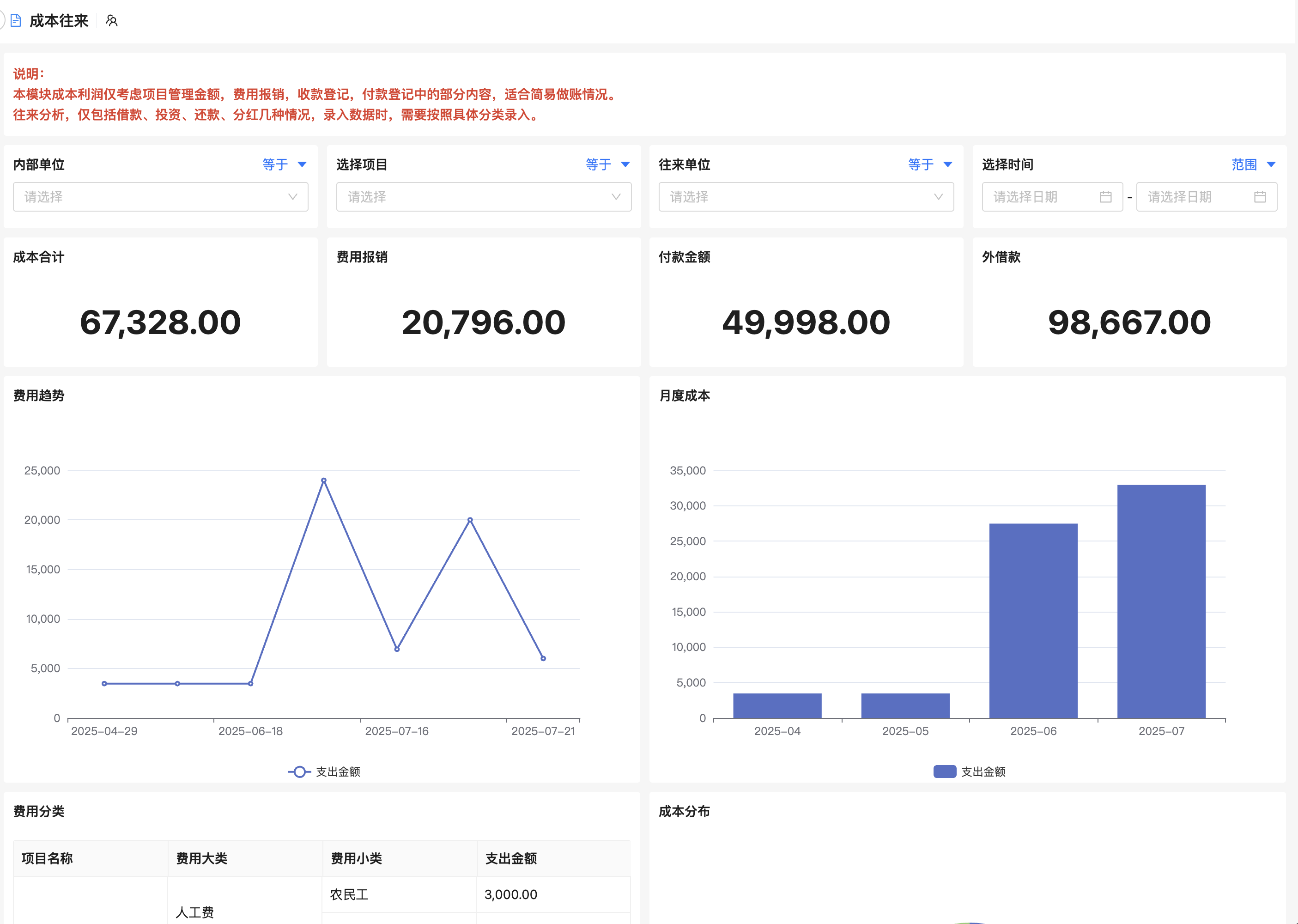
而专业的药物研究项目管理软件能通过统一平台整合项目全生命周期,实现标准化流程、自动化任务分配、实时数据可视分析,并内置审计追踪与电子签名功能,显著降低人为错误和合规风险。
二、核心功能模块设计要点
一个好的药物研究项目管理软件应包含以下关键模块:
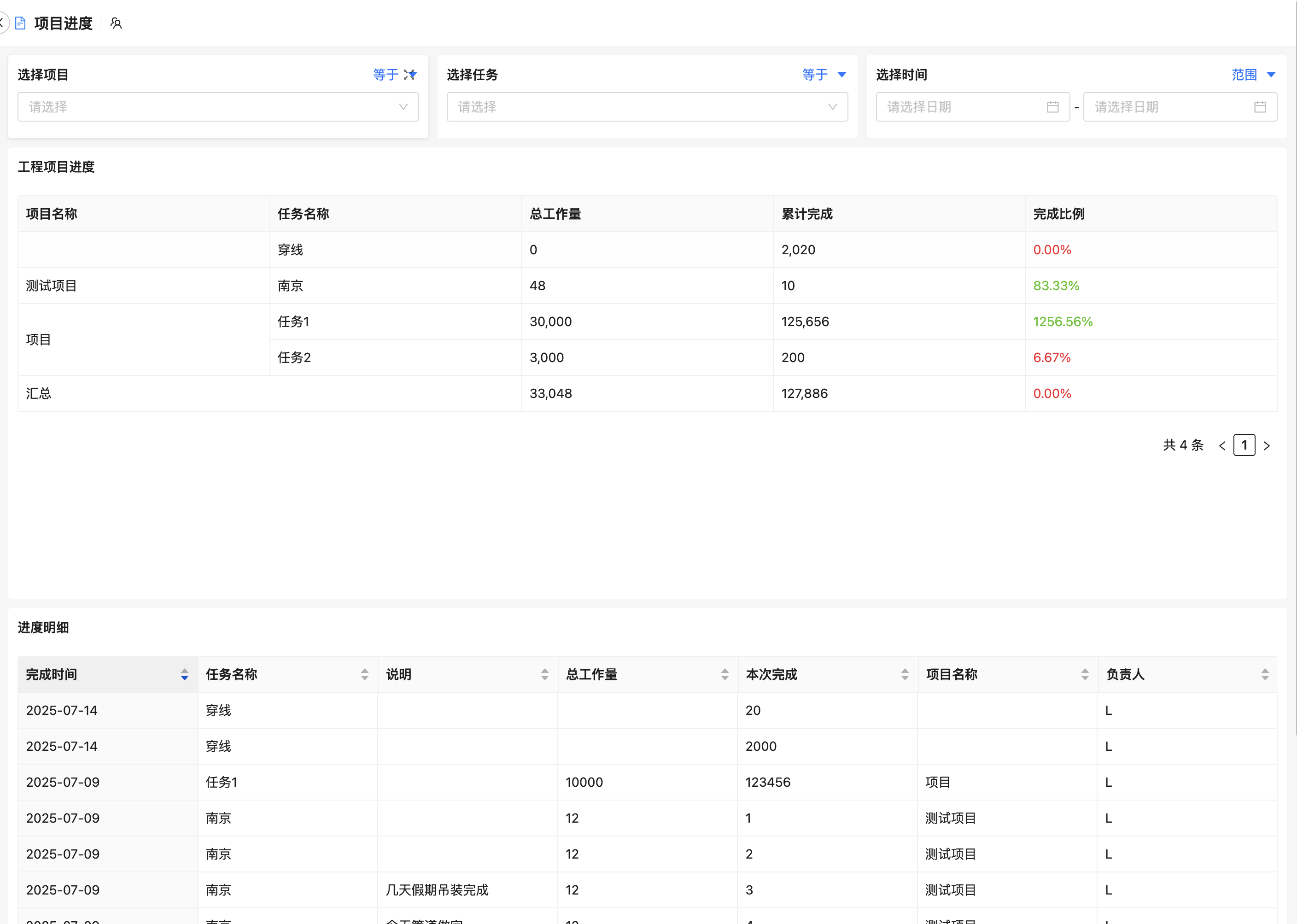
1. 项目规划与执行引擎
支持WBS(工作分解结构)建模,自动生成多级任务树,设定责任人、截止日期、优先级。可对接JIRA、MS Project等外部工具,便于跨组织协同。
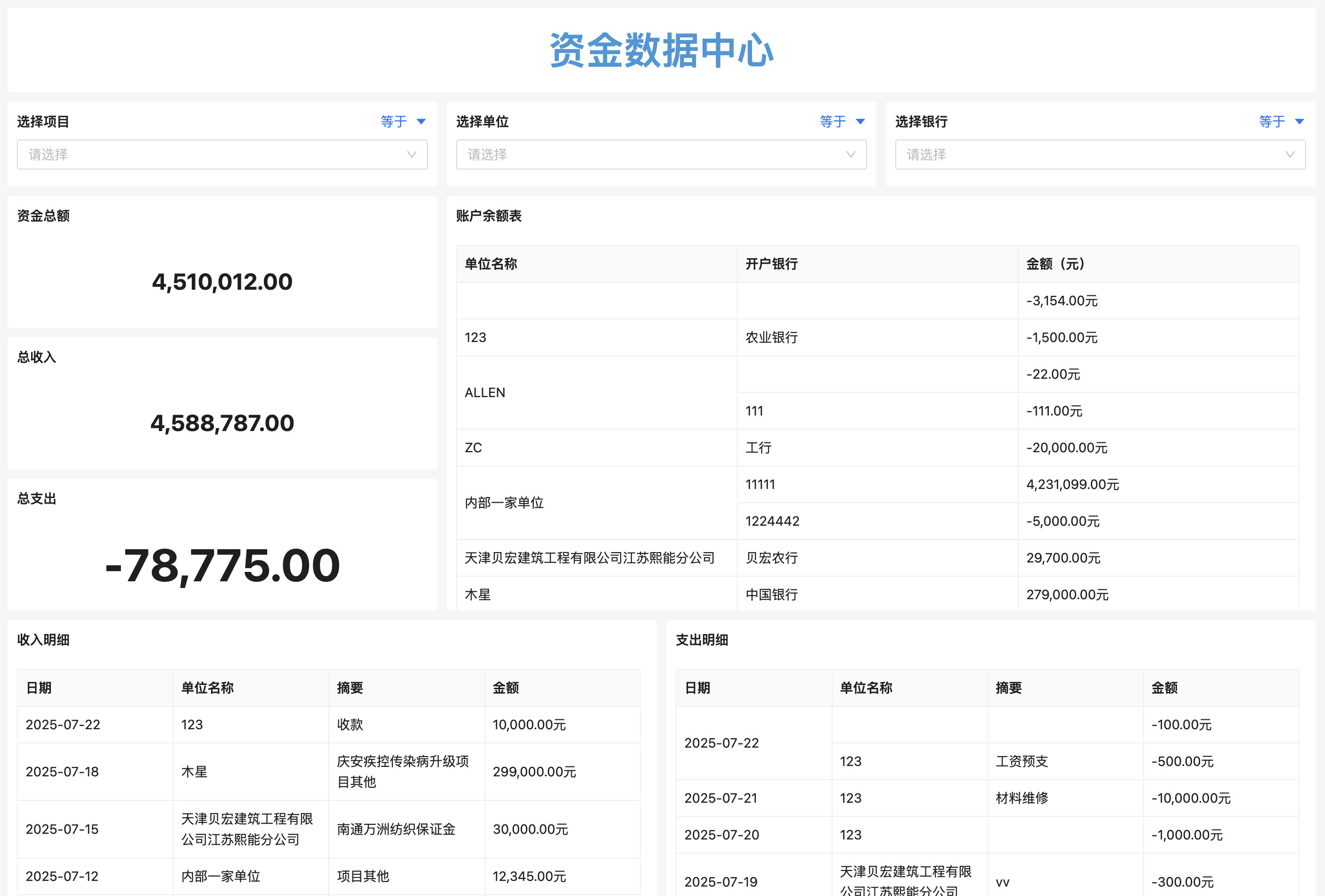
2. 数据集中管理与版本控制
所有实验报告、原始数据、图表、文档均存储于中央数据库,支持版本历史回溯。例如,某化合物的毒性测试数据变更时自动通知相关研究人员,避免重复劳动。
3. 合规性与审计追踪
遵循ISO 14155、ICH-GCP等国际标准,记录用户登录、修改、删除行为,确保“谁在何时做了什么”。具备电子签名功能,满足FDA对电子记录的要求。
4. 风险预警与质量管理
基于AI算法识别潜在延误、预算超支或异常数据趋势,主动推送警报。例如,当某个临床试验中心入组速度低于预期30%时,系统自动提醒项目经理调整策略。
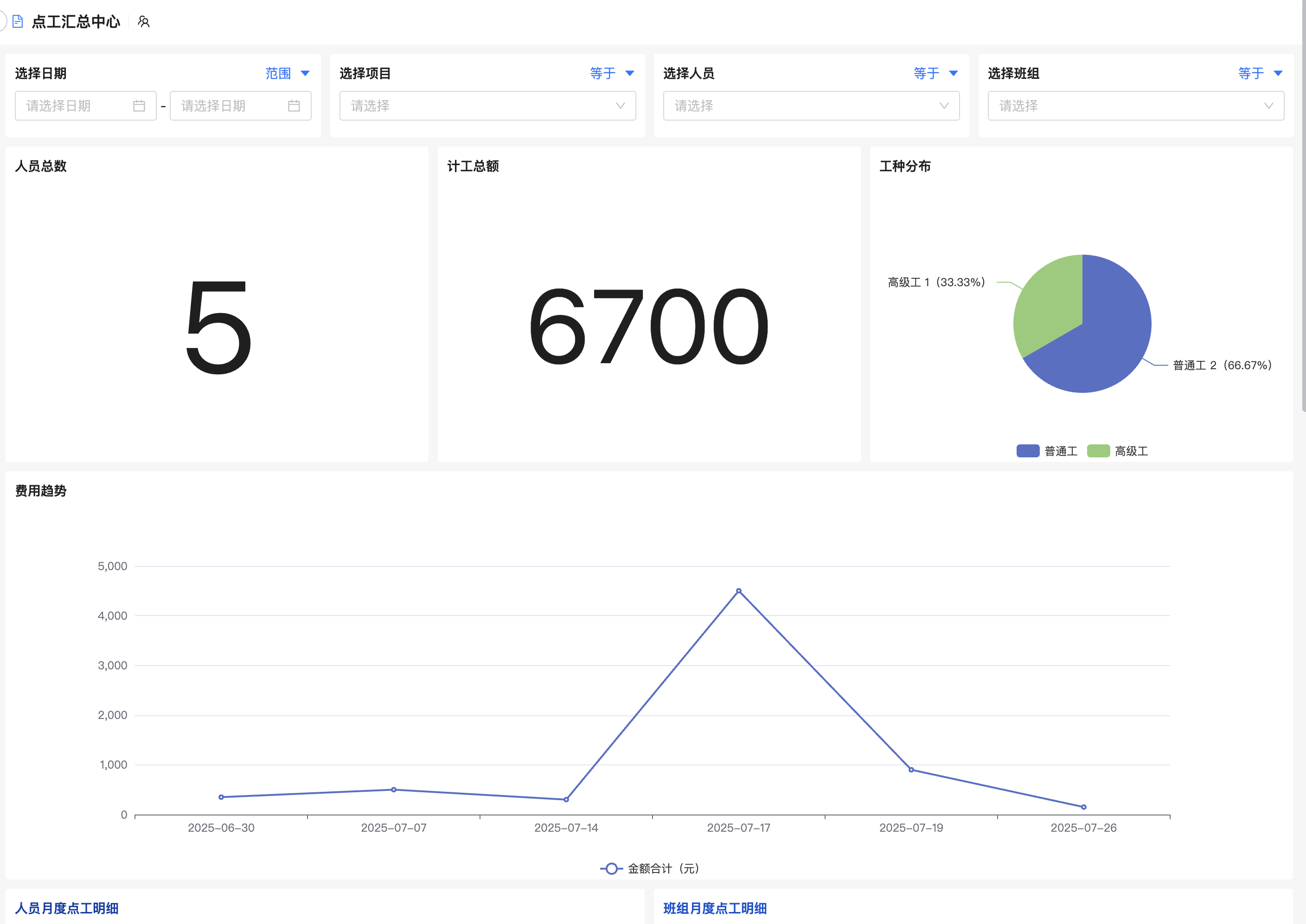
5. 移动端适配与协作平台
提供iOS/Android App,方便研究人员随时上传数据、审批流程或查看状态。内置聊天、评论、@提及等功能,增强团队互动效率。
三、实施路径:从选型到落地
成功的部署不仅取决于软件本身,更依赖于组织变革与流程再造:
第一步:需求调研与评估
明确业务目标(如缩短研发周期20%)、当前痛点、预算范围。邀请研发、QA、IT三方参与评审,避免“技术驱动”而非“业务驱动”的陷阱。
第二步:试点运行与反馈迭代
选择一个小型项目(如一期临床试验)进行试用,收集用户反馈,优化界面逻辑和流程设置。建议周期为2-3个月,形成可复制的最佳实践。
第三步:全员培训与文化转型
组织分角色培训(研究员、项目经理、QC人员),强调“数字原生”理念,鼓励从纸质文档向电子化过渡。设立内部KOL推动习惯养成。
第四步:持续优化与扩展应用
上线后每季度回顾使用率、满意度指标,逐步将更多模块(如供应商管理、注册申报)纳入系统。未来可集成AI预测模型,进一步提升决策质量。
四、成功案例:某跨国药企的应用效果
以某全球TOP 10制药企业为例,在引入定制化的药物研究项目管理软件后:
- 项目平均交付周期由48周缩短至36周,提升25%;
- 因数据不一致导致的重复实验减少60%,节省成本约$2M/年;
- 审计通过率从78%上升至98%,无重大合规处罚;
- 研究人员满意度调查显示,工作效率感知提升40%。
该企业CEO表示:“这不是一个IT项目,而是一次研发文化的数字化跃迁。”
五、未来发展趋势:智能化与生态融合
随着AI、云计算和区块链技术的发展,下一代药物研究项目管理软件将呈现三大趋势:
1. AI赋能预测与优化
利用机器学习分析历史项目数据,预测新项目的成功率、资源需求和风险点,辅助高层制定战略决策。
2. 云原生架构与SaaS模式普及
相比本地部署,云端方案更具弹性、安全性和可扩展性,尤其适合中小药企快速上手。
3. 开放API与生态系统构建
与其他系统(如LIMS、eTMF、EDC)无缝集成,打造“一站式研发服务平台”,促进知识资产沉淀与复用。
总之,药物研究项目管理软件不再是锦上添花的选择,而是决定研发成败的战略基础设施。它不仅是工具,更是组织能力的延伸,是连接科学家、管理者与监管者的桥梁。